اسید نیتریک (HNO۳)، همچنین بهعنوان نیتریک اسید، جوهرشوره یا تیزاب شناخته میشود. اسید نیتریک یک اسید معدنی بسیار خورنده است. ترکیب خالص نیتریک اسید بی رنگ است، اما نمونههای قدیمیتر تمایل دارند به رنگ زرد باشند که به اکسید نیتروژن و آب تجزیه میشوند. بیشتر اسید نیتریک تجاری دردسترس، دارای ۶۸٪ غلظت در آب است. هنگامی که محلول حاوی بیش از ۸۶٪ HNO۳ باشد، بهعنوان اسید نیتریک فومینگ یا دودکننده شناخته میشود. بسته به مقدار درصد نیتروژن دیاکسید، اسید نیتریک فومینگ به عنوان اسید نیتریک دودکننده سفید در غلظتهای بالاتر از ۹۵٪ یا اسید نیتریک دودکننده قرمز در غلظتهای بالاتر از ۸۶٪ مشخص میشود. نیتریک اسید، واکنش اولیه برای نیتروژندار کردن است که از افزودن یک گروه نیترو، به مولکول آلی میباشد. درحالیکه برخی از ترکیبات نیترو باعث انفجار، شوک و حساس به دما اند، تعداد کمی از آنها پایداری مناسب برای استفاده از آنها درمهمات را دارند، در بعضی موارد از اسید نیتریک به عنوان رنگدانه در جوهر و رنگ استفاده میشود. اسید نیتریک نیز معمولا به عنوان یک عامل اکسیدکننده قوی استفاده میشود.


اسید نیتریک عموما به صورت تجاری به صورت آزئوتروپ که حاوی ۶۸%وزنی HN۰۳ موجود است. این محلول دارای دمای جوش ۱۲۰.۵ درجه سانتیگراد در ۱ اتمسفر است. دو جامد هیدراته اسید نیتریک، مونوهیدرات (HNO۳.H۲۰یا [H۳۰]NO۳) و تری هیدرات(HNO۳.۳H۲O) میباشد. اسید نیتریک دارای نقطه ذوب ۴۲- درجه سانتی گراد و نقطه جوش ۸۳ درجه سانتی گراد میباشد. اسید نیتریک چگالی در حدود ۱.۵۱ گرم بر سانتیمترمکعب دارد.
اسید نیتریک دودکننده
اسید نیتریک دودکننده تجاری حاوی ۹۰٪ HNO۳ و چگالی۱.۵۰گرم بر سانتیمترمکعب میباشد. این درجه اغلب در صنعت مواد منفجره استفاده میشود. اسید نیتریک دودکننده یک اسید بدون آب و غیرخورنده است و غلظت تقریبی ۲۱.۴ مولار دارد.
اسید نیتریک دودکننده قرمز، یا RFNA، حاوی مقادیر قابل توجهی دی اکسید نیتروژن محلول است که موجب رنگ قرمز مایل به قهوه ای میشود. چگالی اسید نیتریک قرمز کمتر از ۱.۴۹۰گرم بر سانتیمتر مکعب میباشد.
این نوع از اسید نیتریک IWFNA)یا (IRFNA را میتوان با افزودن ۰.۶ تا ۰.۷ درصد هیدروژن فلوراید (HF) تولید کرد.
اسید نیتریک بدون آب
اسید نیتریک دودکننده سفید، اسید نیتریک خالص یا WFNA بسیارشبیه به اسید نیتریک بدون آب است. اسید نیتریک با خلوص ۹۹.۹ درصد در دسترس است. یکی از مشخصههای اسید نیتریک سفید، آن است که حداکثر در۲ درصد آب و حداکثر در ۰.۵در صد NO۲ حل میشود. اسید نیتریک بدون آب دارای چگالی ۱.۵۱۳ گرم برسانتیمترمکعب و غلظت ۲۴ مولار است. اسید نیتریک بدون آب یک مایع بی رنگ با چگالی ۱.۵۱۲ گرم برسانتیمترمکعب است که در دمای ۴۲- درجه سانتی گراد به بلورهای سفید رنگی کریستاله میشود. همانطورکه به NO۲ و آب تجزیه میشود، یک ته رنگ زردی بهدست میآید و در دمای ۸۳ درجه سانتیگراد به جوش میآید.
استفاده اصلی صنعتی اسید نیتریک برای تولیدکود است. اسید نیتریک برای بدست آوردن نیترات آمونیوم با آمونیاک خنثی میشود. حدود ۷۵-۸۰٪ از ۲۶ میلیون تن تولید سالانه برای این کاربرد مصرف میشود. دیگر کاربردهای اصلی برای تولید مواد منفجره، پیش مادههای نایلونی و ترکیبات آلی مخصوص است.
استفاده از نیتریک اسید در آزمایشگاهها برای انواع سنتزها:
درسنتزهای شیمیایی آلی، صنعتی و غیره، گروه نیترو یک گروه عملکردی است. بیشتر مشتقات آنیلین ازطریق نیترات ترکیبات آروماتیک و سپس کاهش آن تهیه میشود. نیتراتها شامل ترکیب نیترات و اسید سولفوریک برای تولید یون نیترونیوم است که با ترکیبات آروماتیک مانند بنزن واکنش الکتروفیلی میدهند. بسیاری از مواد منفجره مانند TNT از واکنش نیتریک اسید تولید میشوند.
C۶H۵CH۳ + ۳ HNO۳ → C۶H۲ (NO۲) ۳CH۳ + ۳ H۲O
از نیتریک اسید بهعنوان اکسیدانها نیز استفاده میشود.
استفاده از نیتریک اسید در موشکها:
اسید نیتریک در اشکال مختلف بهعنوان اکسیدکننده در موشکهای با سوخت مایع استفاده میشود. این فرمها شامل اسید نیتریک دودکننده قرمز، اسید نیتریک دودکننده سفید و مخلوط با سولفوریک اسید میباشد.
استفاده از نیتریک اسید در آنالیز:
در آنالیز عنصری بهواسطهی ICP-MS، ICP-AES، GFAA و AA اسید نیتریک رقیق (۰.۵تا ۵ درصد) بهعنوان یک ترکیب ماتریسی برای تعیین ردیابی فلزات در محلولها استفاده میشود. اسید فلزی برای آناللیز مورد نیاز است زیرا مقدار کمی از یونهای فلزی میتواند برنتایج تجزیه و تحلیل تاثیر بگذارد.
در الکتروشیمیایی، اسید نیتریک بهعنوان یک ماده دوپینگ شیمیایی برای نیمه هادیهای آلی و در فرآیند تصفیه برای نانولولههای کربن خالص استفاده میشود.
همچنین از نیتریک اسید در نجاری، بهعنوان تمیزکننده و چاپ فلزی و... استفاده میشود.
درغلظت کم (تقریبا ۱۰درصد)، از اسید نیتریک برای کاج و افرا درنجاری استفاده میشود. رنگ تولید شده خاکستری-طلایی میباشد که بسیار شبیه به موم بسیارقدیمی یا براقکننده چوب است.
اثرات خورنده اسید نیتریک برای تعدادی از کاربردها، از قبیل چاپ فلزی، تراشیدن فولادضدزنگ یا تمیزکردن سیلیکون در الکترونیک مورد استفاده قرار میگیرد.
محلول اسید نیتریک، آب و الکل، نیتال، برای اچینگ کردن فلزات در نشان دادن ریزساختارآنها مورد استفاده قرارمیگیرد. ایزو ۱۴۱۰۴ یکی از استانداردهای این روش شناخته شده است.
محلول صنعتی ۵-۳۰٪ اسید نیتریک و ۱۵-۴۰٪ اسید فسفریک معمولا برای تمیزکردن تجهیزات موادغذایی و لبنی جهت حذف ترکیبات رسوبی کلسیم و منیزیم استفاده میشود. (یا استفاده از فرآیند بخار در طی تولید و تمیزکردن .( مقدار اسید فسفریک به حذف آلیاژهای آهن در برابر خوردگی توسط اسید نیتریک رقیق کمک میکند.


اسید نیتریک یک اسید خورنده و عامل اکسیدکننده قوی است. خطر اصلی ناشی از آن، سوختگیهای شیمیایی است، زیرا هیدرولیز اسید با پروتئین و چربی (استر) انجام میشود که درنتیجه آن بافتهای زنده تجزیه میشود (به عنوان مثال پوست و گوشت) با این وجود، اثرات سیستمیک بعید است و مادهای سرطان زا محسوب نمیشود.
درمان استاندارد برای مواجهی اسید روی پوست، همانند دیگر مواد خورنده، شستشو با مقدار زیادی آب است. توصیه میشود شستشو با آب حداقل ۱۰-۱۵ دقیقه برای خنککردن بافت اطراف و جلوگیری از آسیب ثانویه ادامه دادهشود. لباس آلوده بلافاصله خارج شود و پوست زیر آن کاملا شسته شود.
اسید نیتریک به دلیل اکسیدکنندگی قوی، میتواند با ترکیباتی مانند سیانید، کاربید، یا پودرفلزات انفجاری و با بسیاری از ترکیبات آلی واکنش نشان دهد.
نیتریک اسید از واکنش نیتروژن دی اکسید (NO۲) با آب ساخته میشود.
۳ NO۲ + H۲O → ۲ HNO۳ + NO
بهطورمعمول، نیتریک اکسید تولید شده بهواسطهی واکنش، توسط اکسیژن هوا برای تولید دی اکسید نیتروژن اضافی دوباره اکسیداسیون میشود.
دی اکسید نیتروژن بهوسیله پراکسید هیدروژن میتواند به بهبود عملکرد اسید کمک کند.
۲ NO۲ + H۲O۲ → ۲ HNO۳
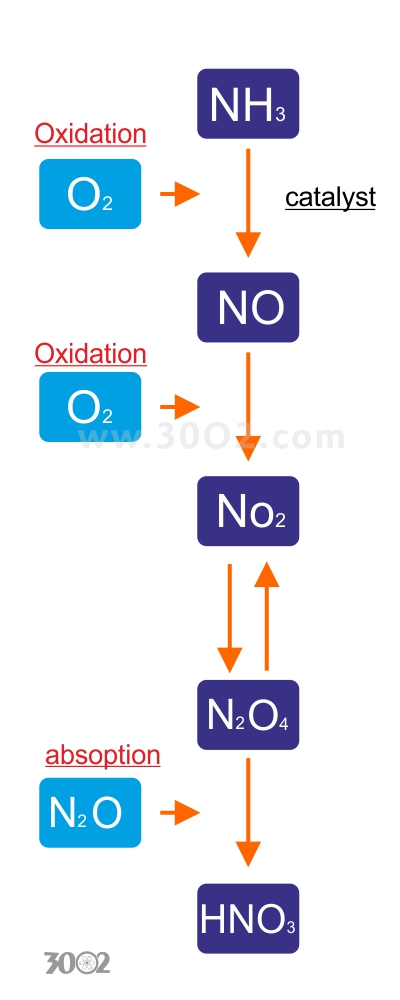
محلول اسید نیتریک تجاری معمولا بین ۵۲ تا ۶۸ درصد اسید نیتریک دارد. تولید اسید نیتریک از طریق فرآیند استوالد است که به افتخار نام شیمیدان آلمانی ویلیام استوالد نامگذاری شده است. در این فرآیند، آمونیاک بدون آب به اکسید نیتریک ، درحضورکاتالیزورگازپلاتین یا ردیوم در دمای بالا حدود ۵۰۰ کلوین و فشار ۹ اتمسفر اکسید میشود.
(۴ NH۳ (g) + ۵ O۲ (g) → ۴ NO (g) + ۶ H۲O (g) (ΔH = −۹۰۵.۲ kJ
سپس با آب برای تشکیل نیتریک اسید و نیتریک اکسید واکنش میدهد.
(۳ NO۲ (g) + H۲O (l) → ۲ HNO۳ (aq) + NO (g) (ΔH = −۱۱۷ kJ/mol
اکسید نیتریک برای دوباره اکسید شدن به سیکل برمیگردد و اگر در معرض اکسیژن هوا قرارگیرد:
(۴ NO۲ (g) + O۲ (g) + ۲ H۲O (l) → ۴ HNO۳ (aq
با غلظت ۹۸٪ بدون آب میتواند به H۲SO۴ تبدیل شود. با استفاده از آمونیاک بهدست آمده از فرایند هابر، محصول نهایی را میتوان از نیتروژن، هیدروژن و اکسیژن تولیدکرد که از هوا و گازطبیعی به عنوان مواد اولیه تولید میشوند.
قبل از معرفی فرآیند هابر برای تولید آمونیاک در سال ۱۹۱۳، اسید نیتریک با استفاده از فرآیند بریکلند-اید به دست میآمد. این فرآیند همچنین بهعنوان فرآیند قوسی نیز شناخته میشد. این فرآیند براساس اکسیداسیون نیتروژن توسط اکسیژن به اکسید نیتریک در دمای بسیار بالا است. برای قوس الکتریکی، دمای بالا مورد استفاده قرارگرفت و اکسید نیتریک تا ۴ درصد بهدست آمد. اکسید نیتریک با اکسیژن باقیمانده جو به اکسید نیتروژن اکسید شد و سپس در اسید نیتریک رقیق شده بهدستآمد. دراین فرآیند انرژی بسیار زیاد بود و زمانیکه آمونیاک ارزان قیمت موجود بود، بواسطه فرآیند استوالد بهسرعت جایگزین شد.
روش ساخت آزمایشگاهی:
در آزمایشگاه، اسید نیتریک می تواند با تجزیه حرارتی نیترات مس (II) ساخته شود، و سپس تولید دی اکسید نیتروژن و گازهای اکسیژن، که از طریق آب به اسید نیتریک منتقل میشود.
(۲ Cu(NO۳)۲ → ۲ CuO (s) + ۴ NO۲ (g) + O۲ (g
مسیرجایگزین با واکنش حجمهای تقریبا مساوی ازهرنوع نیترات مانند نیترات سدیم با ۹۶ درصد اسید سولفوریک (H۲SO۴) و تقطیر این مخلوط در نقطهجوش اسیدهای نیتریک در۸۳ درجه سانتیگراد است. مواد تهنشین شده غیرفرار سولفات هیدروژن در مخزن تقطیر باقی میماند. اسید نیتریک قرمز ممکن است به اسید نیتریک سفید تبدیل شود.
NaNO۳ + H۲SO۴ → HNO۳ + NaHSO۴
NOX
حل شده بهراحتی با استفاده از کاهش فشار در دمای اتاق حذف میشود (۱۰تا دقیقه در ۲۰۰ میلیمترجیوه یا ۲۷ کیلوپاسکال) تا اسید نیتریک دودکننده سفید بهدست آید. این روش همچنین میتواند تحت فشار و دمای کم در یک مرحله بهمنظورکاهش تولید گاز دی اکسید نیتروژن باشد.
در آزمایشگاه، چگالش شامل تقطیر با اسید سولفوریک یا نیترات منیزیم است که بهعنوان عامل دهیدراسیون عمل میکند. این تقطیرها باید با دستگاه تمام شیشه درفشارکم صورت گیرد تا ازتجزیه اسید جلوگیری شود. درصنعت، تولید اسید نیتریک با غلطت بالا توسط حلشدن دی اکسید نیتروژن اضافی در ۶۸ درصد اسید نیتریک است. اکسید نیتروژن حلشده یا در اسید نیتریک دودکننده سفید است یا درمحلول باقی میماند تا نیتریک اسید دودکننده قرمز را تشکیل دهد. به تازگی، مواد الکتروشیمیایی برای تولید اسیدهای بدون آب از مواداولیه اسید نیتریک تغلیظ یافته، گسترش یافتهاند.

خواص پایه اسیدی:
اسید نیتریک معمولا یک اسید قوی در دمای محیط بهحساب میآید. اختلاف نظرهایی درمورد مقدارحد تفکیک نیتریک اسید وجود دارد، اگرچه مقدار pKa معمولا کمتر از۱- گزارش میشود. این بدان معنی است که نیتریک اسید درمحلول رقیق شده، کاملا از هم جدا یا تفکیک میشوند، به جز در محلولهای بسیاراسیدی. مقدار pKa در دمای۲۵۰ درجه سانتیگراد به ۱ میرسد.
واکنش با فلزات:
اسید نیتریک با اکثر فلزات واکنش میدهد، اما بستگی به غلظت اسید و ماهیت فلز دارد. نیتریک اسید رقیق شده با بیشتر فلزات واکنش میدهد. منیزیم، منگنز و روی با اسید نیتریک واکنش داده و هیدروژن آزاد میشود.
اسید نیتریک میتواند فلزاتی غیرفعال مانند مس و نقره را اکسید کند. محصولات این فلزات غیرفعال یا الکتروپوزیتیو کم، به دما و غلظت اسید بستگی دارند. برای مثال، مس با اسید نیتریک رقیقشده در دمای محیط با استوکیومتری۳:۸ واکنش نشان میدهد.
۳Cu + ۸HNO۳ → ۳Cu۲+ + ۲NO + ۴H۲O + ۶NO−۳
بعضی از فلزات گرانبها مانند طلا خالص و فلزات گروه پلاتین با اسید نیتریک واکنش نشان نمیدهند. با این حال، برخی از فلزات نجیب (مس، نقره و...) موجود در برخی از آلیاژهای طلا میتوانند بهراحتی اکسید شده و توسط اسید نیتریک حل شوند، که منجر به تغییر رنگ در سطح آلیاژ طلا میشود. اسید نیتریک همچنین در جواهرفروشیها بهمنظور تشخیص سریع خلوص طلا (کمتر از ۱۴ قیراط) استفاده میشود.
با استفاده از یک عامل اکسیدکننده قوی، میتوان نیتریک اسید را با بسیاری از ترکیبات غیرفلزی واکنش داد. بسته به غلظت اسید، دما و عامل کاهشدهنده، محصولات نهایی میتواند متغیر باشد. بهعنوان یک قاعده کلی، واکنشهای اکسیداسیون عمدتا با اسید رخ میدهند، که به شکلگیری دی اکسید نیتروژن (NO۲) کمک میکند. حضور مقدارکمی اسید نیتریک (HNO۲) واکنشپذیری را به میزان قابل توجهی افزایش میدهد. اگرچه کروم (Cr)، آهن (Fe) و آلومینیوم (Al) بهراحتی با اسید نیتریک یک لایه اکسید فلزی را تشکیل میدهند که فلز را از اکسیداسیون محافظت میکند. این لایه محافظ، لایه رویین یا پسیو نامیده میشود. لایه رویین معمولی از ۲۰ تا ۵۰ درصد حجم دارد. فلزاتی که توسط اسید نیتریک با ایجاد لایه رویین محافظت میشوند شامل: آهن، کبالت، کروم، نیکل و آلومینیوم هستند.
واکنش با غیرفلزات:
اسید نیتریک بهعنوان یک اسید اکسیدکننده قوی، با بسیاری از مواد آلی واکنش نشان میدهد. نیتروژن ترکیبات آلی با اسید نیتریک، روش اولیه سنتز بسیاری از مواد منفجره معمولی مانند نیتروگلیسیرین و ترینیتروتولوئن (TNT) است.
از اسید نیتریک در سده شانزدهم برای جداسازی طلا از نقره استفاده میشد. اسید نیتریک را از شوره بهدست میآورند؛ بدین طریق که سولفات آهن یا زاج را در حالت گرم روی شوره اثر میدادند. این طریقه تولید نشان میدهد که شوره مصرفی، خالص بودهاست .روش سولفات آهن باز بوسیله گلوبر شرح داده شدهاست. این روش بدون شک تا آغاز سده هجدهم، تنها روش مورد استفاده برای تولید نیتریک اسید بودهاست. انگلیسیها و هلندیها تا مدتها بعد هم از روش سولفات آهن استفاده میکردند؛ اما در فرانسه روش آلومین جای آن را گرفت. در سده پیش، تولید کنندگان اسید نیتریک گمان میبردند که بازده تولید با روش آلومین از بازده آن با سولفات آهن کمتر است. کمی پس از آن نظر مخالف غلبه یافت بدون اینکه معلوم شود که برپایه کدام مشاهدات این تغییر عقیده ایجاد شدهاست.
سایت فروش مواد شیمیایی ۳۰O۲ با فروش انواع اسیدهای شیمیایی قوی و ضعیف به صورت اینترنتی، تحت برندهای مطرحی همچون مرک، سیگما آلدریچ و ... موجب تسهیل در امر خرید مواد شیمیایی مختلف می شود. اسید نیتریک نیز به عنوان یک از از اسیدهای قوی از این قاعده مستثنی نبوده و فروش این اسید شیمیایی در سایت ۳۰O۲ انجام می گیرد.