اسید سولفوریک، یا سولفوریک اسید (H۲SO۴)، همچنین با نام روغن ویتریول یا سولفات هیدروژن نیز شناخته میشود. اسید سولفوریک در گذشته نام جوهر گوگرد داشته است. اسید سولفوریک مایع چگال، بی رنگ، روغنی و خورنده میباشد. اسید سولفوریک یکی از مهمترین ترکیباب شیمیایی است که توسط واکنش آب با سولفور تری اکسید تهیه میشود. سولفور تری اکسید نیز به وسیله ترکیب شیمیایی گوگرد دی اکسید و اکسیژن توسط فرآیند تماسی یا فرآیند محفظه ای تولید میشود. در غلظتهای مختلف اسید سولفوریک در تولید کود، رنگدانهها، رنگها، داروها، مواد منفجره، مواد شوینده، نمکها و اسیدهای معدنی و همچنین در پالایش نفتی و فرآیندهای متالورژی استفاده میشود. اسید سولفوریک در یکی از معروفترین کاربردها به عنوان الکترولیت در باتریها استفاده میشود. اسید سولفوریک خالص دارای وزن مخصوص ۱.۸۳۰ در دمای ۲۵ درجه سانتیگراد است . اسید سولفوریک در دمای ۱۰.۳۷ درجه سانتیگراد منجمد میشود. دمای ذوب اسید سولفوریک ۱۰درجه سانتیگراد و دمای جوش آن ۳۳۷ درجه سانتیگراد است. هنگامیکه گرم میشود، اسید خالص به طور جزئی به آب و سولفور تری اکسید تجزیه میشود. اسید سولفوریک مولکولهای با گشتاور قطبی است که میتوانند با هم پیوند هیدروژنی ایجاد کنند. به همین علت اسید سولفوریک مایعی با نقطه جوش بالا و ویسکوزیته زیاد است و به همین علت سولفوریک اسید در آب به راحتی حل شده و میتواند محلولهای اسیدی مختلف تولید کند. اسید سولفوریک جزء اسیدهای بسیار قوی است و در کنار مواد آتشزا و آب به شدت واکنش نشان میدهد و موجب انفجارمیشود. در هنگام گرم شدن باعث انتشار گازهای بسیار سمی میشود. اسید سولفوریک در رده مواد خطرناک برای انسان میباشد. اسید سولفوریک در محلولهای آبی بهطور کامل یونیزه میشود تا یونهای هیدرونیوم (H۳O +) و یون های هیدروژن سولفات (HSO۴-) را تشکیل دهد. علاوه بر اینکه اسید سولفوریک یک ماده اکسیدکننده است، به راحتی در دمای بالا با بسیاری از فلزات، کربن، گوگرد و سایر مواد واکنش نشان میدهد. انتظار میرود تولید جهانی اسید سولفوریک در سال ۲۰۱۸ به ۲۶۰ میلیون تن و تا سال ۲۰۳۰ به بیش از ۲۶۰ میلیون تن برسد. مطالعه بر روی ویتریول یا اسید سولفوریک در دوران باستان آغاز شد. سپس سومریها فهرستی از انواع ویتریول را داشتند که بر اساس رنگ مواد طبقهبندی شده بود. برخی از اولین مباحث در مورد منشاء و خواص سولفوریک اسید در آثار پزشکی یونانی و طبیعتگرد رومی یافت شده است. برای اولین بار کیمیاگرانی چون جابر ابن حیان و زکریای رازی، اسید سولفوریک یا ویتریول را کشف کردند و در فهرست طبقهبندی مواد معدنی قرار گرفت. ابن سینا بر استفادههای پزشکی و انواع مختلف ویتریول اشاره دارد. اسید سولفوریک توسط کیمیاگران اروپایی قرون وسطی به نام روغن ویتریول نام گذاری شد.

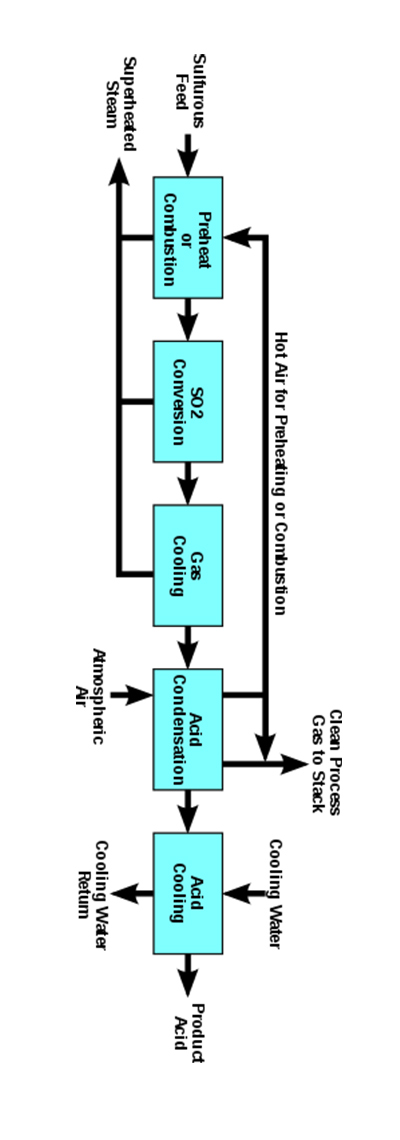
در قرن هفدهم، شیمیدانی آلمانی، اسید سولفوریک را با سوزاندن گوگرد همراه با پتاسیم نیترات در حضور بخار بهدست آورد. جان بروک در سال ۱۷۴۶ در بیرمنگام روش فرآیند محفظه را برای تولید اسید سولفوریک در اتاقهای سربی بهدست آورد که این روش قویتر، ارزانتر و در محفظه شیشه ای بزرگتری میتواند ساخته شود. این روش فرآیند محفظه تولید صنعتی اسید سولفوریک را امکان پذیر ساخت و امروزه نیز از این روش تولید صنعتی استفاده میکنند. سپس در سال ۱۸۳۱، فیلیپس فرآیند تماسی را برای تولید اسید سولفوریک ارائه کرد که فرآیندی بسیار اقتصادیتر برای تولید سولفور تری اکسید و اسید سولفوریک میباشد. امروزه تقریبا تمام اسید سولفوریک جهان با استفاده از این روش تولید میشود. پروسه تولید اسید سولفوریک چهار مرحله دارد:
الف) استخراج گوگرد
ب) تبدیل گوگرد به گوگرد دی اکسید
ج) تبدیل دی اکسید گوگرد به گوگرد تری اکسید
د) تبدیل تری اکسید گوگرد به اسید سولفوریک
الف) استخراج گوگرد به راحتی مهمترین منبع گوگرد، از گاز طبیعی و روغن به دست میآید که حاوی ترکیبات سولفور، هر دو سولفید آلی و هیدروژن که قبل از استفاده از آنها، به عنوان سوخت یا مواد شیمیایی استفاده می شود.یکی دیگر از منابع مهم سولفور، سولفور دی اکسید از تصفیه فلز است. سنگ معدن بسیاری از فلزات سولفیدها اند و به فرم اکسید و سولفور دی اکسید در میآیند مانند ساخت سرب. فلزات دیگر که از سنگ معدن سولفید ساخته شدهاند عبارتند از مس، نیکل و روی. در سراسر جهان حدود ۳۵ درصد گوگرد به عنوان دی اکسید سولفور از سنگ معدن سولفید به دست میآید. اسید سولفوریک همچنین از سولفات آمونیوم، که یک محصول جانبی در تولید پلی (متیل ۲-متیل پروپونات) است، به دست میآید.
ب) تبدیل گوگرد به گوگرد دی اکسید اگر گوگرد مواد اولیه باشد، ابتدا باید به دی اکسید گوگرد تبدیل شود. گوگرد به یک کوره اسپری میشود و در انفجار هوای خشک در حدود K ۱۳۰۰ سوزانده میشود. گوگرد با مشخصه شعله آبی میسوزد. هوای اضافی، بهصورت گازهایی در حدود ۱۰-۱۲٪ گوگرد دی اکسید و ۱۰٪ اکسیژن پدیدار میشود. گازها بسیار داغ هستند و از مبدلهای حرارتی (دیگهای بخار گرمایی) عبور میکنند. سپس گازها خنک شده و آب دراطراف لولههای دیگ بخار به بخار آب تبدیل میشود. در تولید یک تن اسید سولفوریک، یک تن بخار فشار بالا نیز تولید میشود.
ج) تبدیل دی اکسید گوگرد به تری اکسید گوگرد (فرآیند تماسی) یک دستگاه معمولی شامل یک مخزن استوانهای است که به عنوان یک عمل واکنش بستر ثابت با چهار بستر جداگانه از کاتالیزور میباشد که یک مبدل شناخته میشود و بهوسیله آن دی اکسید گوگرد و هوا عبور میکنند. کاتالیزور، وانادیوم اکسید برای سیلیس، (در واقع یک ماده است که سرعت واکنش را افزایش میدهد بدون اینکه از لحاظ شیمیایی درگیر شود، جایگزین میشود) به شکل گلولههای کوچک است که سولفات سزیم به عنوان یک پروموتر اضافه شده است (عملکرد پروموتر به منظور کاهش نقطه ذوب وانادیوم میباشد)
د) تبدیل سولفور تری اکسید به اسید سولفوریک تری اکسید گوگرد که از بستر سوم تشکیل شده است (و مقدار کمی از آن توسط بستر چهارم) به اسید سولفوریک تبدیل میشود. سولفور تری اکسید با آب واکنش داده و سولفوریک اسید تولید میشود. اسید سولفوریک در حدود ۹۸% غلظت استفاده میشود . با اضافه کردن آب و حذف اسید، در این غلظت نگهداشته میشود. از دیگر روشهای تولید اسید سولفوریک میتوان به موارد زیر اشاره کرد: در یک روش، سولفوریک اسید را میتوان در آزمایشگاه از واکنش گاز گوگرد دیاکسید با هیدروژن پراکسید به دست آورد. در روش دیگر تولید سولفوریک اسید در آزمایشگاه با استفاده از الکترولیز محلول مس (ll) میباشد که کاتد باید از فلزی باشد که رسانایی خوبی دارد، مانند مس و آند نیز باید از جنس پلاتین یا زغال باشد تا با محلول واکنش ندهد.
از تولید جهانی اسید سولفوریک در جهان، تقریبا نیمی از آن به تولید سوپر فسفات و کودهای مرتبط با آن مربوط میشود مانند تولید کود فسفات، کلسیم دی هیدروژن فسفات و فسفات آمونیوم. اسید سولفوریک دارای کاربردهای فراوانی در صنعت میباشد. به طور گستردهای درفرآیندهای فلزی به عنوان مثال در تولید مس و تولید روی و در تمیز کردن سطح ورق فولادی کاربرد دارد. از اسید سولفوریک برای ساخت قوطی غذا قبل از اینکه آن را در یک ورقه نازک از قلع بپوشانند، استفاده میشود. همچنین به عنوان یک رنگدانه نیز کاربرد دارد. در میان بسیاری از کاربردهای دیگر اسید سولفوریک، تولید اسید هیدروفلوئوریک و فنول با پروپانون است که در بسیاری از صنایع کاربرد دارد.
استفادههای دیگر از اسید سولفوریک در تولید بنزین اکتان بالا، دی اکسید تیتانیوم، مواد منفجره، مصالح ساختمانی، چسب ، به عنوان واکنش اسیدی و استفاده در دارو، باتریها، کاتالیزور، محصولات خود مراقبتی، محصولات برق والکترونیک، در منسوجات، رنگ و پوششها، صنایع چوبی، صنایع پلاستیک، کنترل PH و ماده ضدعفونیکننده میباشد.
اسید یک ماده شیمیایی است که محلول آن دارای مزه ترش و مقدار ph کمتر از ۷ می باشد که به دو دسته قوی و ضعیف تقسیم می شود. اسید سولفوریک به عنوان یک اسید قوی دارای کاربرد صنعتی و آزمایشگاهی فراوانی می باشد. فروش اسید سولفوریک به عنوان یکی از مواد شیمیایی پر فروش، در سایت فروش مواد شیمیایی ۳۰o۲ عرضه می گردد. شرکت آریا نوین نزدیک به دو دهه به فروش انواع اسیدها از جمله اسید سولفوریک صنعتی و آزمایشگاهی پراخته است که با توجه به افزایش تقاضا در عرضه محصولات شیمیایی و همچنین ورود این شرکت به ارائه خدمات اینترنتی، با راه اندازی سایت فروش مواد شیمیایی گام بزرگی در ارائه خدمات به مشتریان خود برداشته است.